Mulette épaisse (Unio crassus)
|
Noms
Classification : Mollusca / Bivalvia / Unionida / Unionidae |
Statuts de conservation (listes rouges UICN)
Statut réglementaire : espèce protégée |
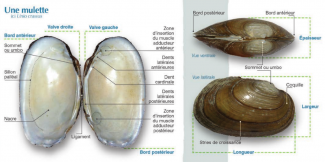
La Mulette épaisse est un mollusque bivalve, sa coquille est en 2 parties (valves).
Forme de la coquille : Unio crassus peut présenter une grande variété de formes et de couleurs mais elle est généralement ovoïdale (Adam, 1960) et verdâtre.
Il existe différents morphotypes et couleurs selon les zones, substrats... et populations, et également une évolution au cours du temps : les individus âgés (environ plus de 15 ans) peuvent présenter une forme auriculées.
Ses valves sont plus ou moins allongées et inéquilatérales, c’est-à-dire non symétrique vis-à-vis. Les stries présentes sur le sommet (umbo) sont continues et ondulées. Elle comporte des dents cardinales et latérales postérieures. L'intérieur est lisse et nacré.
Taille : en France, la Mulette épaisse adulte peut atteindre une longueur de 80 mm (Prié, 2017).
Habitat
Une moule d'eau douce
C’est un organisme benthique, il vit partiellement ou totalement enfoui en milieu aquatique continental, selon son cycle de vie).
"La Mulette épaisse vit toujours dans des cours d’eau présentant de faibles contraintes de cisaillement, avec généralement de fortes proportions de sédiment fin et de matière organique. Elle s’accommode aussi bien de grands cours d’eau que de petits ruisseaux, parfois même dans des substrats sablo-vaseux. Elle s’établit indifféremment dans le lit des rivières ou dans les berges, sous la végétation. Bien qu’elle soit plutôt liée au calcaire en France, certaines populations s’accommodent de milieux plus acides (ex. dans l’Allier) et elle peut même vivre en sympatrie avec la Mulette perlière en Belgique ou en Allemagne." (Extrait de Naïades et autres bivalves d’eau douce de France, V. Prié, 2017).
Types d’habitats aquatiques associés
- Typologie Eunis : C2.3 - Cours d’eau permanents non soumis aux marées, à débit régulier
- Corine Biotope : 24.1 - Lits des rivières
Facteurs limitants
La qualité du substrat peut influer sur la survie des individus, et notamment des juvéniles établis dans les sédiments. Lorsque des matériaux fins s’y accumulent, ce colmatage par entraîne un manque d’oxygène disponible dans l'eau filtrée par les mulettes.
Les ouvrages modifiant la ligne d’eau ou empêchant la circulation des individus poissons-hôtes (seuils, barrages...) constituent par rebond des obstacles à la circulation des larves et donc des populations (cf. Reproduction).
Cycle de vie (alimentation, reproduction et paramètres démographiques)
Régime alimentaire : organisme filtreur
La Mulette épaisse se nourrit d’organismes et de particules organiques de petite taille : algues, organismes unicellulaires, débris organiques... par filtration de l'eau.
L'eau est aspirée grâce à un siphon « inhalant » et rejetée via un siphon « exhalant ». Les cténidies, des branchies, font office de filtres. Elles jouent également un rôle dans la reproduction puisque les œufs y seront stockés.
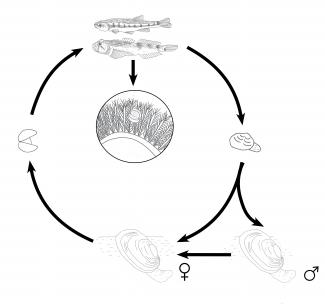
Reproduction : un mollusque dioïque et ovipare
Chez la Mulette épaisse, la reproduction débute au printemps et se poursuit jusqu’au milieu de l’été (Bauer 2001). Les sexes sont séparés (espèce dioïque). L'ensemble du cycle de vie se déroule en 2 à 4 ans.
Les mâles émettent les spermatozoïdes dans la colonne d’eau, filtrés par les femelles. Les gamètes mâles ainsi récupérés fécondent les ovocytes des femelles. Les oeufs éclosent par la suite en larves : des glochidies. Une femelle peut produire entre 9 000 et 100 000 glochidies au cours de la saison de reproduction (Bauer 2000). Elle expulse ("crache") ensuite les glochidies dans le milieu, qui vont se fixer sur des poissons utilisés comme « hôtes ».
| Des stratégies élaborées Les stratégies d'expulsion diffèrent, toujours dans l'objectif de favoriser l’absorption des glochidies par les poissons. Ainsi certaines femelles se positionnent pour faire émerger leurs siphons à la surface de l'eau lors de l'expulsion des glochidies. Elles retombent à la surface, provoquant un remous, une onde. Les poissons les « gobent » croyant que ce sont des insectes. |
Les « poissons-hôtes » sont des moyens de transport. Les larves se fixent aux branchies à l’aide de deux crochets et s’enkystent plusieurs jours. La durée varie en fonction des espèces de poisson et des conditions du milieu. Cette étape est primordiale pour la survie des larves et la dispersion de l’espèce. Elles profitent de la mobilité des poissons pour se disperser et remonter le courant de la rivière, impossible par leurs propres moyens.
Une fois la période d’enkystement terminée, la larve devenue moule juvénile se décroche et tombe au fond du cours d’eau. Elle s’enfouit dans le substrat pendant 3 à 4 ans ((Tudorancea & Gruia 1968, Cucherat, et observations).
Comportement (mode de vie, domaine vital)
Domaine vital : espèce sédentaire
Pour les individus, il est de l’ordre de quelques mètres à dizaines de mètres.
Pour un population le domaine vital s’entend, a minima, du tronçon de cours d’eau et jusqu’au cours d’eau dans son intégralité.
Déplacements : courts "à pied", plus importants via taxis
La mulette épaisse au stade moule est capable de déplacements courts, de l’ordre de quelques mètres. Elle se déplace à l’interface substrat-eau grâce à un pied musculeux enfoui dans le substrat. Les motifs sont la reproduction, la recherche de meilleures conditions ou pour fuir un stress (pollution, baisse du niveau d’eau).
Au stade larvaire, l'espèce profite de la mobilité de certains poissons utilisés comme « poissons-hôtes » (voir partie précédente Cycle de vie).
Répartition géographique et situation de l'espèce
Répartition de l'espèce
La France constitue la limite occidentale de son aire de répartition, ce que reflète sa répartition localement, avec les plus grosses populations situées dans le tiers nord-est du pays. On l’a longtemps crue absente du sud du bassin de la Loire, mais des observations récentes (ADNe et observation directe) montrent qu’elle est présente de manière marginale dans les bassins de la Charente et dans les ruisseaux de tête de bassin de la Dronne. Bien qu’il existe quelques données muséologiques, elle n'a jamais été retrouvée dans le bassin de la Dordogne. Elle était considérée rare et localisée (voire disparue) dans quelques stations de la Camargue et de l’aval du Rhône. Des analyses ADNe ont montré récemment qu’elle semble être bien présente dans le Rhône, jusqu’à l’aval, où elle était passée inaperçue.
Extrait du Guide technique Mulette épaisse et autres bivalves, 2021
Cartes de répartition de l'espèce sur le site de l'INPN
Menaces sur l'espèce
Comme d’autres organismes vivant à l’interface eau - sédiment, la Mulette épaisse est dépendante de la qualité de l’eau et de la qualité du substrat.
Son cycle de vie intégrant des poissons-hôtes, elle est doublement impactée par les atteintes aux milieux : par effet direct sur les individus, et indirectement par impact sur les peuplements de poissons.
Conditions du milieu : pollution, modification de l'habitat, sécheresse
Les pollutions font parties des menaces. Même si elle supporte des eaux légèrement eutrophes, elle est sensible à la désoxygénation du milieu (Lamand F., observations personnelles). Elle n’est également pas observée dans les milieux très pollués.
La modification physique des milieux (travaux, modification du lit mineur, …) ont également un impact négatif par destruction directe, causée par les engins et par modification des conditions du milieux (écoulements, substrat…).
Cette espèce, strictement aquatique, est également sensible au manque d’eau et/ou aux températures trop élevées. Avec l’augmentation en fréquence et en intensité des sécheresses, l’assèchement des cours d’eau représente une menace importante. Au cours des étés 2020 et 2022, plusieurs cours d’eau du Grand Est, abritant l’espèce, ont été asséchés.
Présence d'autres espèces : prédation, parasitisme, compétition
La mulette subit une prédation par des espèces considérées comme exotiques envahissantes (EEE), telles que le rat musqué et le ragondin (pour le ragondin la prédation est fortement supposée mais non avérée).
D’autres espèces, considérées comme autochtones ont aussi un impact négatif sur les mulettes.
C’est le cas de la bouvière, poisson qui se reproduit en parasitant les moules d’eau douce. Elle y pond ses œufs et les larves s’y développent. Le stress induit peut être létal pour les individus parasités.
De nouvelles espèces invasives ou exotiques envahissantes, telles que Corcicula, Dreissena et Sinanodonta woodiana, entrent en compétition avec les espèces autochtones.
Changement climatique
Le changement climatique impacte la biocénose environnante des bivalves. Outre les effets cités précédemment dans conditions du milieu, la hausse des températures perturbe également la répartition des poissons-hôtes. Leur variation de disponibilité devient un facteur limitant à l’expansion de l’espèce.
De plus, l'évolution climatique vers un réchauffement peut favoriser certaines espèces exotiques compétitrices.
Ces phénomènes sont encore mal connus et restent à étudier.
Réglementation
Statut juridique
- Statut communautaire (UE) : espèce nécessitant une protection stricte – annexes II et IV – Directive Habitats
- Statut national : espèce protégée – Arrêté du 23 avril 2007 ainsi que l'Arrêté du 6 janvier 2020
Réglementation
Arrêté du 23 avril 2007 : article 2
L'arrêté concernant la Mulette épaisse interdit entre autres toute destruction intentionnelle ou enlèvement des œufs, ainsi que la destruction ou la perturbation intentionnelle des animaux. La protection de ses habitats (sites de reproduction et aires de repos) interdit toute intervention sur ces milieux particuliers à l'espèce et notamment tout type de travaux susceptibles de les altérer ou de les dégrader. Il est également interdit de détenir, de transporter ou de réaliser toute action commerciale avec des individus prélevés dans le milieu naturel.
Observation, étude et gestion
Méthodes de détection
Cette espèce est difficilement détectable en méthode visuelle car les individus peuvent s’enfouir totalement ou partiellement dans le substrat. Seuls les individus partiellement enfouis sont détectables avec des méthodes visuelles (aquascopes, plongée). Un « œil averti » est nécessaire puisque les individus sont mimétiques des cailloux et souvent encroûtés (biofilm, algues, …). Ainsi seules les ouvertures des syphons sont détectables à l’œil.
Des méthodes de détection tactile peuvent être utilisées notamment en présence de vases. Elle est rarement utilisée car elle peut présenter un risque sanitaire pour l’opérateur.
L'excavation de substrats consiste à creuser le substrat et à le trier à l’aide d’un tamis. Il est possible d’utiliser un tellinier pour des sondages ponctuels ou une pelle et un filet type surber pour la mise en œuvre de protocoles. Ces techniques d’investigation sont lourdes à mettre en œuvre et invasives pour le milieu : elles déstructurent le substrat et peuvent induire du piétinement. Elles sont donc à mettre en œuvre avec parcimonie.
Il existe aujourd’hui des méthodes de détection basées sur la recherche d’ADN environnemental (ADNe). Cette analyse constitue une méthode fiable et non invasive pour détecter la totalité des espèces de bivalves sur une distance pouvant aller jusqu’à 5-10 km en fonction des cours d’eau. Elle a pour limite principale de ne pas permettre la localisation précise de la population détectée.
> Visionner le webinaire ADN Environnemental, un outil efficace pour la connaissance et le suivi de la biodiversité ? Cas des bivalves d'eau douce (2019)
> En savoir plus sur la méthode de l'ADN environnemental
Études menées à l'OFB
L'OFB étudie depuis plusieurs années la thématique des bivalves d’eau douce, les naïades et particulièrement la Mulette épaisse (en Centre-Val de Loire depuis 2018, et dès 2009 en Grand-Est).
Les nombreuses prospections permettent d’améliorer les connaissances de répartition des différentes espèces, ciblées par analyses cartographiques en Centre-Val de Loire.
Les études fournissent en complément des informations sur la détection des individus, les protocoles de prospection, les poissons-hôtes, les pêches de sauvetage, la transplantation d’individus, mais également sur les effets des assecsen période de sécheresse.
Les analyses d’ADN environnemental sont particulièrement utiles là où la prospection est impossible ou difficile, comme par trop de profondeur. Une campagne d'ampleur menée sur 100 points ADNe en territoire Grand Est a pu fournir de nombreuses données. Elle a été financée par des partenaires du collectif régional Biodiversité (Dreal, AERM, AESN, Région) et avec l’appui des CEN de Lorraine et Champagne-Ardennes.
Ces études ont permis de créer plusieurs outils :
- des bases de données régionales contribuant aux données INPN, et en Grand-Est les données sont valorisées sous la forme d'un Atlas des naîades de la région.
- des collections de coquilles, celle de Centre-Val de Loire es cours de constitution dans un but d’éducation à la prise en compte de ces taxons. Une stratégie régionale cadre l’activité de ces référents taxonomiques.
- et un guide de détermination.
Les partenaires sont également sensibilisés à la prise en compte de ces espèces dans les projets d’aménagement ou de restauration des milieux.
Entre autres résultats, des travaux de recharge sédimentaire ont pu être stoppés, et un tronçon de cours de l’Eure et Loir classé en par arrêté préfectoral de protection de biotope (APPB).
Aller plus loin : guide pour mieux prendre en compte la mulette épaisse (et bivalves) dans les projets (2021).
Informations complémentaires et références
Informations complémentaires
- Guide technique Mulette épaisse et autres bivalves - Quels projets doivent les prendre en compte et comment ? Dreal Grand Est, DRIEAT Ile-de-France, Décembre 2021
- Lamand F., et Priez V., 2017. Détermination des mollusques bivalves de France - Naïades et petits bivalves d'eau douce. Guides et protocoles, AFB, 2017..
- Guide Espèces protégées, aménagements et infrastructure : recommandations pour la prise en compte des enjeux liés aux espèces protégées et pour la conduite d'éventuelles procédures de dérogation au sens des articles L.411-1 et L.411-2 du code de l'environnement dans le cadre des projets d'aménagements et d'infrastructures, Ministère de l'Écologie, du Développement durable et de l'Énergie, 2012
- Prié V., 2017.- Naïades et autres bivalves d’eau douce de France. Biotope, Mèze, Muséum national d’Histoire naturelle, Paris (collection Inventaires & biodiversité), 336p.
Fiche espèce – Cahiers d’habitats Natura 2000. Tome 7
Autres espèces protégées possédant des habitats similaires (fiches INPN)
• Écrevisse à pattes blanches, Austropotamobius pallipes (Lereboullet, 1858)
• Loutre d’Europe, Lutra lutra (Linnaeus, 1758)
• Chabot commun, Cottus gobio (Linnaeus, 1758)
• Vandoise, Leuciscus leuciscus (Linnaeus, 1758)
Bibliographie
- Lamand F. & Cucherat X. 2021. Les Naïades de la région Grand-Est : état des connaissances et perspectives. Naturae (6).
- Prié, V., A. Valentini, P. Jean, J.-B. Decotte, É. Breugnot, S. Couprie, G. Jardin, F. Lamand, N. Roset, T. Vigneron, M. Rocle, , X. Cucherat, T. Dejean & P. Taberlet 2021a. - Cinq ans d’inventaires des Bivalves de France par analyse de l’ADN environnemental : quelles conclusions, quelles perspectives ? In Léonard, L. (éd.), Colloque national de malacologie continentale, Nantes, 6 et 7 décembre 2018. Naturae 2021 (8) : 91-114.
- Prié, V., A. Valentini, M. Lopes-Lima, E. Froufe, M. Rocle, N. Poulet, P. Taberlet & T. Déjean, 2020. - Environmental DNA metabarcoding for freshwater bivalves biodiversity assessment: methods and results for the Western Palearctic (European sub-region). Hydrobiologia
- Taeubert, J. E., G. El-Nobi & J. Geist, 2014.- Effects of water temperature on the larval parasitic stage of the thick-shelled river mussel (Unio crassus). Aquatic Conservation: Marine and Freshwater Ecosystems 24: 231–237
- Lamand, F. & J.-N. Beisel 2014.- Proposal for a simple hydromorphological habitat survey method for freshwater bivalve (Unionidae) inventories. Aquatic Ecology. 48 (2): 237-245.
- Lamand F., Roche K., Beisel J-N., 2014. Glochidia of the endangered mollusc Unio crassus in rivers of northeastern France : Eurasian Minnow and bullhead are primary host fish. Aquatic conservation.
- Lamand F., Beisel J-N., 2014. Comparison of visual observation and excavation to quantify density of the endangered bivalve Unio crassus in rivers of north-eastern France, Knowl. Managt. Aquatic Ecosyst. 413. 11
- Prié, V. & N. Puillandre 2014.- Molecular phylogeny, taxonomy and distribution of French Unio species (Bivalvia, Unionidae). Hydrobiologia 735 (1): 95-110
- Cucherat X., 2013. Bilan des connaissances sur les espèces de mollusques continentaux de la Directive Habitats-Faune-Flore dans la région Nord-Pas-de-Calais durant la période 1992-2011. MalaCo 9, 467–484.
- Douda K., 2013. Quantifying the host relationships of endangered freshwater mussels – Unio crassus demonstrates a need for unifying methodologies. Biological Conservation 159, 548–549.
- Douda K., Horký P.,Bílý, M., 2012. Host limitation of the thick-shelled river mussel: identifying the threats to declining affiliate species. Anim Conserv 15, 536–544.
- Taeubert J.-E., Gum B., Geist J., 2012a. Host-specificity of the endangered thick-shelled river mussel (Unio crassus, Philipsson 1788) and implications for conservation. Aquatic Conserv: Mar. Freshw. Ecosyst. 22, 36–46.
- Taeubert J.-E., Martinez A.M.P., Gum B., Geist J., 2012b. The relationship between endangered thick-shelled river mussel (Unio crassus) and its host fishes. Biological Conservation 155, 94–103.
- Bichain J.-M., Wagner A., 2010. Un nouvel espoir pour Unio crassus Philipsson, 1788 (Mollusca, Bivalvia, Unionidae) en Alsace. MalaCo 6, 264.
- Douda K., 2010. Effects of nitrate nitrogen pollution on Central European unionid bivalves revealed by distributional data and acute toxicity testing. Aquatic Conserv: Mar. Freshw. Ecosyst. 20, 189–197.
- Vrignaud, S., 2009. Les Unionidés de France. Rev. sci. Bourgogne-Nature 9-10, 180–187.
- Bauer G. 2001.- Life-history variation on different taxonomic levels of Naïads. In Bauer, G. & K. Wächtler 2001, Ecology and Evolution of the Freshwater Mussels Unionoida. 394 pp
- Bauer G. 2000. — Life-history variation of different taxonomic levels of Naiads, in BAUER G. & Wächtler K. (eds.), Ecology and evolution of the freshwater mussels Unionoida, Vol. 145. Berlin, Springer. p. 83–91. (Ecological Studies).
- Tudorancea, C. & L. Gruia 1968.- Observation on the Unio crassus Philipsson population from the Nera River. Travaux du Muséum d'histoire naturelle "Grigore Antipa" 8 (1): 381-394.